はじめに
全世界的に酪農場および繁殖肉牛農場の飼養規模が拡大しており、さらに乳牛においては高泌乳化に伴う発情徴候の微弱化1)が観察されている。この問題に対応するため、ホルモン剤を使用した定時人工授精プログラムの利用が急速に広がってきている。
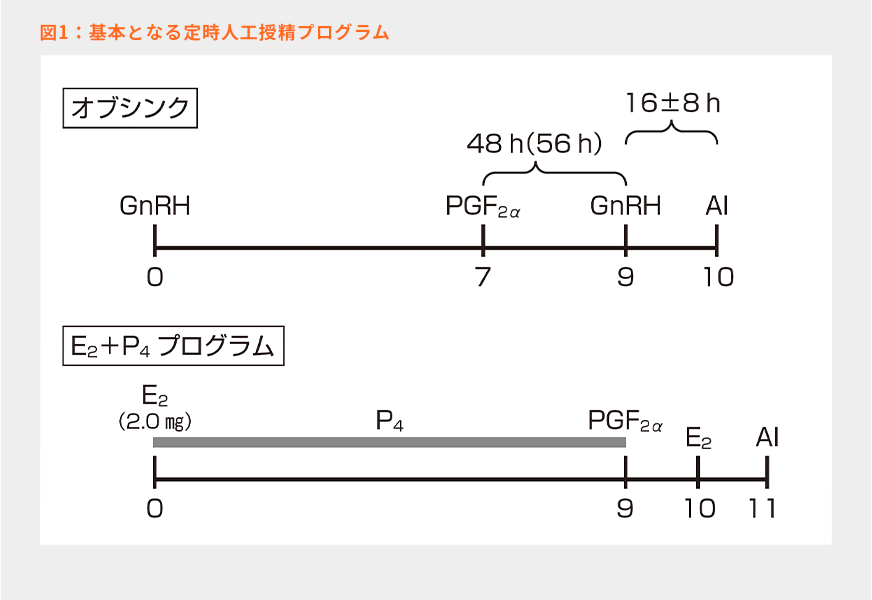
現在、日本で利用されている定時人工授精プログラムは主にオブシンクとE2+P4プログラムの2つではないかと思う(図1)。この2つのプログラムは新規卵胞波発現の原理がまったく異なり、この点を十分に理解することが、実際の現場で使用する時にとても重要だと考えている。特にエストラジオール(E2)とプロジェステロン(P4)を用いたE2+P4プログラムは日本において非常に広く利用されているが、このプログラムに関して原理も含めて十分に解説されたものは少ないと感じている。これらの原理を理解することで、両者の長所と短所を認識し、より効果的な定時人工授精プログラムを組めるようになると考えている。
そこで、本稿では定時人工授精プログラムの基本となるオブシンクとE2+P4プログラムについて、その原理と注意点を改めて説明し、議論していく。
定時人工授精プログラムの原理と注意点
抗定時人工授精プログラムは、基本的には大きく以下の4点のプロセスから成り立っている:①卵胞波の発現誘起、②主席卵胞の発育、③黄体退行誘起、④排卵誘起である。
①卵胞波の発現誘起
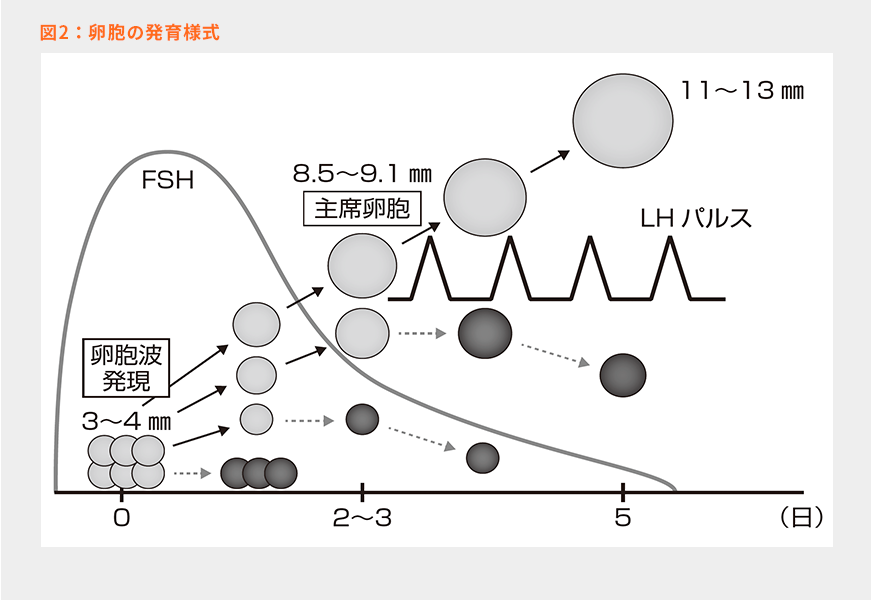
卵胞波とは図2の模式図で示したように、卵胞が発育する様式のことである。下垂体前葉から一過性に放出される卵胞刺激ホルモン(FSH)により、卵巣内で直径3~4㎜の小卵胞が多数発育を開始する(卵胞波発現:0日目)。小卵胞は時間とともに大きくなっていくが、血中FSH濃度の低下に伴い多くの小卵胞は死んでいく(閉鎖)2)。この時、卵胞波のなかで8.5~9.1㎜に最初に達した卵胞は黄体形成ホルモン(LH)のパルスに反応できるようになり、そのまま発育を継続できるようになる3、4)(卵胞波発現:2~3日目)。この卵胞を主席卵胞という。主席卵胞は卵胞波発現から5日目になると、11~13㎜にまで発育する4)。FSHの放出は、主席卵胞で産生・放出されるインヒビンにより抑制されているが、主席卵胞が閉鎖、または排卵により消失すると、血中インヒビン濃度が低下するので、FSHの一過性放出が起こる。つまり、新たな卵胞波を誘起するためには、その時点での主席卵胞を消失させ、FSHの一過性放出を誘導すればいいことになる。定時人工授精で最終的に授精させる卵子は新規に発育し、健康な卵胞から放出される必要がある。卵胞波の発現からの日齢が経ちすぎて卵子が老化している場合、受胎率が低下する可能性がある5)。そのため、卵胞波発現をこちらのタイミングで確実に行うことが高い受胎性を得るためには重要である。
②主席卵胞の発育
主席卵胞が十分に発育することで、確実な排卵誘起を可能にすることができ、さらに黄体退行から排卵誘起までの間に卵胞から産生されるE2の血中濃度を十分に高めることができる。
③黄体退行誘起
排卵を同期化するためには、我々のタイミングで黄体退行を誘起する必要があり、誘起前に黄体が自然退行してしまうと、早期に発情が発現し、さらには定時授精前に排卵してしまう可能性がある。そのため、退行誘起時には機能性黄体が存在する、または血中P4濃度が高く維持されている必要がある。
④排卵誘起
適期に人工授精を実施するために、排卵誘起は内因性のLHサージが起こる前に実施する必要がある。一方で、オブシンクの場合、黄体退行誘起から排卵誘起までの時間が短い(36時間より短い)と受胎率が低下することが報告されているので6)、最低でも36時間(基本は48~56時間)は空ける必要があると考える。
発情同期化プログラムの卵胞波発現の原理とその注意点
以下にそれぞれのプログラムの原理について説明していく。特に新規卵胞波発現の原理に注目していただきたい。
1.オブシンクの原理と注意点
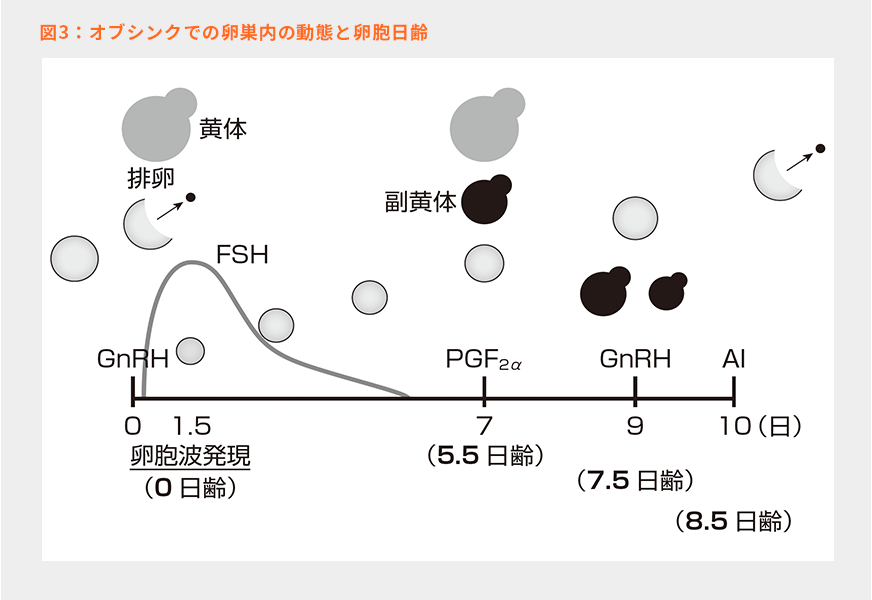
図3はそれぞれのホルモン剤投与により、卵巣内でどのような反応を経るのかを模式化したものである。以下にその流れをまとめた7、8)。
①Day 0の性腺刺激ホルモン放出ホルモン(GnRH)投与は、LHサージ(投与後2時間)を誘起して主席卵胞の排卵を促すためである。投与から28~32時間後に排卵が起きるため、投与から1.5~2日後に新たな卵胞波が発現する。
②Day 7には卵胞は5~5.5日齢に発育しており、このタイミングでプロスタグランジン(PG)F2αを投与し、黄体と副黄体の退行を誘起する。
③PGF2α投与の48~56時間後に7~8日齢の卵胞となる。この十分に成熟させた主席卵胞を排卵誘起するためにGnRHを再び投与する。
④GnRH投与後、28~32時間で排卵が起きるので、投与から8~24時間後の8~9日齢の卵胞に対して授精を実施する。
オブシンクでは、主席卵胞を排卵させることで新たな卵胞波発現を誘起する。このため、GnRH投与時点でLHサージに反応することができる主席卵胞が存在しない(閉鎖または若すぎる)と、新規卵胞波の発現が失敗するという欠点がある。では、GnRH投与によって排卵させることができる卵胞のサイズはいくつからか?
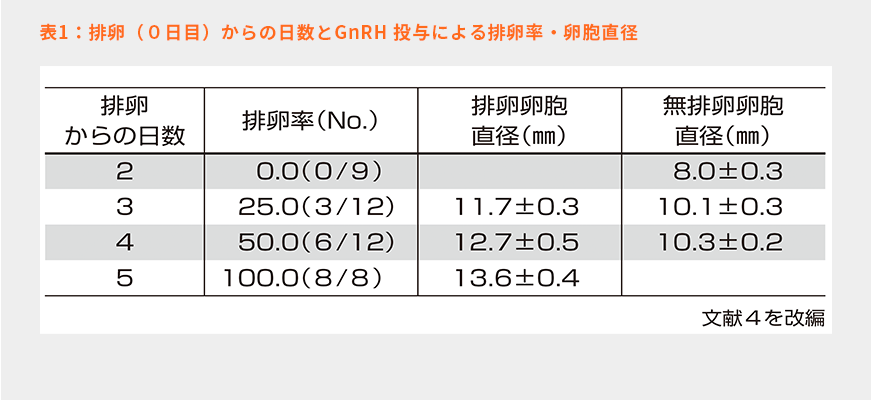
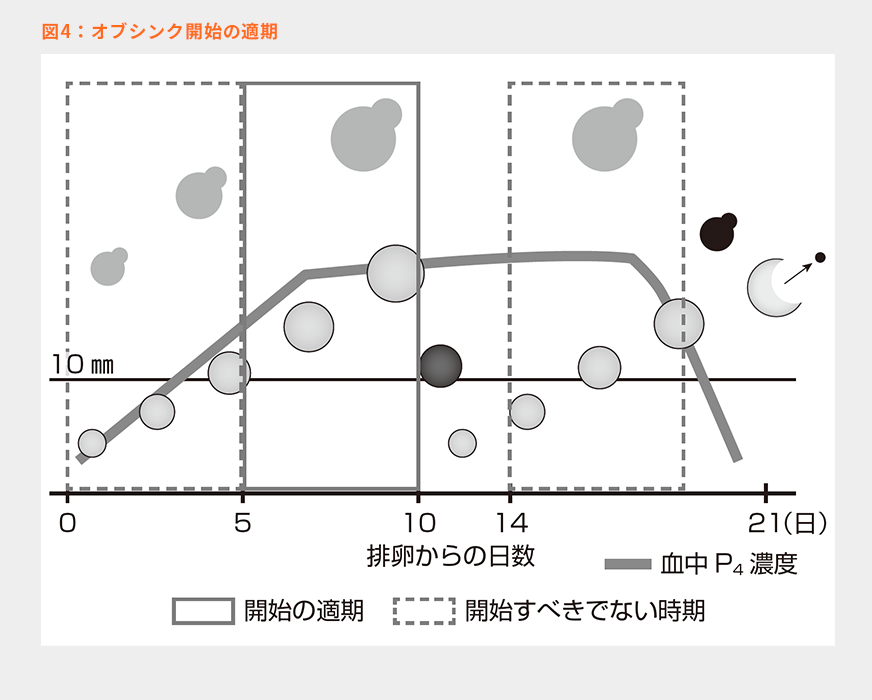
表1のホルスタイン種経産泌乳牛のデータでは、排卵から4日目(卵胞波発現から4日目)、直径にして10㎜以下では100%の確率で排卵させられないことが示されている。発情周期の5日目であれば第1卵胞波主席卵胞が11㎜を超え、さらに10日目前後まで生きている9)。よって発情周期の5~10日の間はGnRH投与により排卵誘起することができるため、オブシンク開始の適期とされている(図4:灰色枠)。発情周期の14日目以降でも第2卵胞波主席卵胞が十分に発育しGnRHに反応できるようになるが、この時期以降からオブシンクを開始すると、PGF2α投与までに機能性黄体が退行してしまうので、この時期に開始すべきではないと指摘されている(図4:破線枠)。この問題を解決するために、GnRH投与と同時に腟内留置型P4製剤を挿入することで、PGF2α投与前に黄体の自然退行が起きても早期の発情および排卵を防ぐことができ、排卵同期化の失敗を防ぐことができる。
プレシンクやダブルオブシンクなどを実施されている方もいらっしゃるかと思うが、これらはオブシンク開始の適期(発情周期の5~10日目)に当たるように、オブシンクの開始前に事前に周期を合わせるための処置である。周期が分かる状況では、これらの事前同期化は必要ないことになる。
2.E2+P4プログラムの原理と注意点
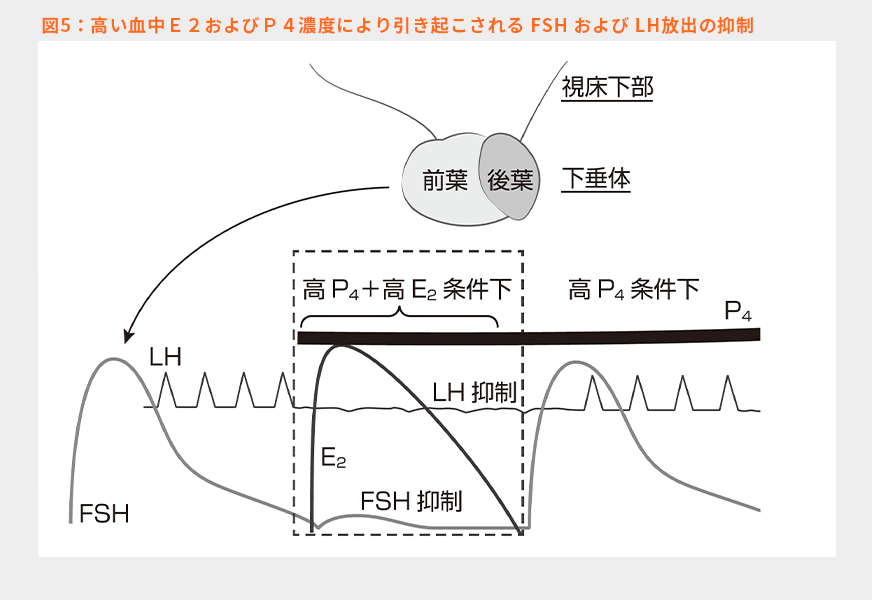
このプログラムは卵胞波発現誘起のためにE2とP4(腟内留置型P4製剤)を使用するもので、Boら10)やBurkeら11)によりその原理が報告されている。図5はその原理を示した模式図である。上述したように下垂体からFSHおよびLHは放出されているが、通常の生理状態では起こりえない血中でのE2およびP4がともに高い条件を人為的に作り出すと、下垂体からのFSHおよびLHパルスの放出が抑制されるという現象が観察される。そして、高E2+高P4条件が継続している間はFSHおよびLHの放出は抑制される。しかし、この高E2を解除すると、FSHの一過性の放出とLHパルス放出が再開される。
これを、プログラムとして行った際にどのように卵巣が反応するのかを模式化したのが図6である。先生方の多くは、E2+P4プログラムでもP4製剤留置期間を7日間にされていると思われるが、本稿ではオリジナルの方法の9日間留置で話を進めていく。この理由は黄体退行誘起時の卵胞の日齢をオブシンクでの日齢と合わせるためである。
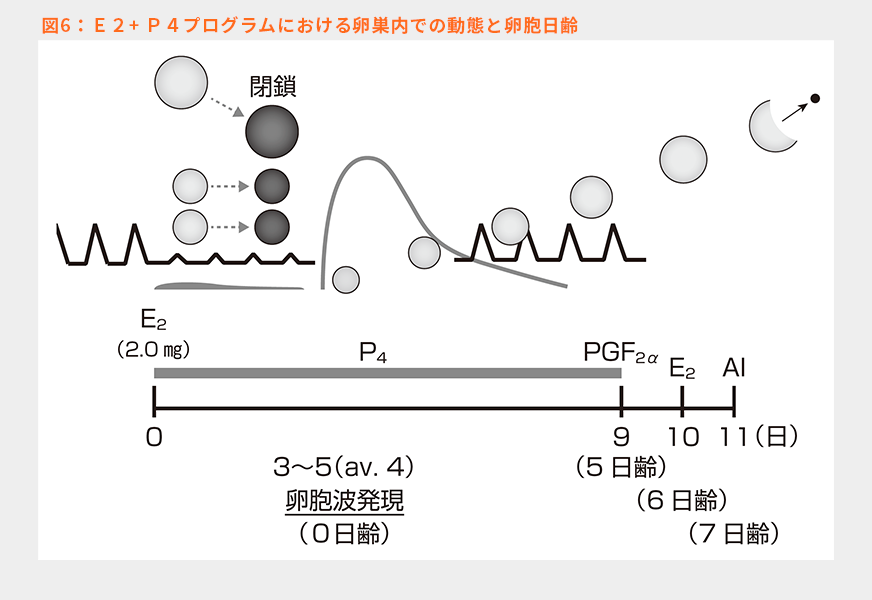
①Day 0にE2(2.0㎎)を筋肉内投与し、同時にP4製剤を挿入すると、高E2+高P4条件が作出され、下垂体からのFSHとLHの放出が抑制される。小卵胞および主席卵胞は閉鎖する。
②筋肉内投与されたE2は徐々に分解されて血中E2濃度が低下していく。その結果、高P4条件のみとなり主席卵胞が存在しないのでFSHの一過性放出が起こり、卵胞波発現が誘起される。その時期はE2投与から3~5日目(平均4日目)である。
③Day 9には卵胞は約5日齢に発育しており、このタイミングでPGF2αを投与し、黄体の退行を誘起する。
④PGF2α投与のおよそ24時間後に約6日齢の卵胞となり、排卵誘起のためにE2を投与する。投与からおよそ23時間でLHサージのピークが観察される12)。そのため、排卵はE2投与のおよそ53時間後に起きる。
⑤E2投与から24~36時間後の7~7.5日齢の卵胞に対して授精を行う。
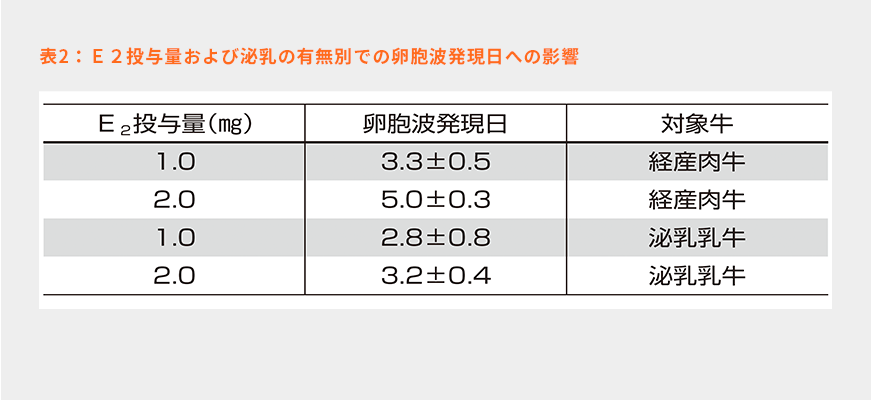
E2+P4プログラムはオブシンクのように主席卵胞を排卵させることで卵胞波発現を誘起するのではなく、下垂体からのFSHとLHの放出を制御することで卵胞波発現に必要な主席卵胞の閉鎖を引き起こし、新たな卵胞波を発現させる方法である。そして、このプログラムの最も有利な点は、発情周期に関係なくプログラムを開始することができることである。筆者は様々な発情周期の様々な時期にこのプログラムを開始したが、発情日、排卵日であっても新規卵胞波発現を誘導することができている。しかしながら、このプログラムで重要なのは、高い血中E2濃度が投与後どの程度長時間維持されるかにより、卵胞波発現時期が変わるということである。表2は泌乳乳牛と経産肉牛それぞれでのE2投与量別の卵胞波発現日を示している13)。このことから、投与量の増加により卵胞波発現は遅れるが、同じ投与量であれば泌乳乳牛でその発現日が早いことが分かる。泌乳牛では高泌乳に伴い肝臓でのE2代謝が高まることが指摘されており、高泌乳牛(ホルスタイン種泌乳牛)では血中E2濃度の低下が速く、2.0㎎のE2投与では卵胞波発現が3~3.5日になる可能性があり、一方で、黒毛和種は卵胞波発現が4~5日になると推測される(図7)。こうなると排卵誘起日の卵胞の日齢が異なることになる。
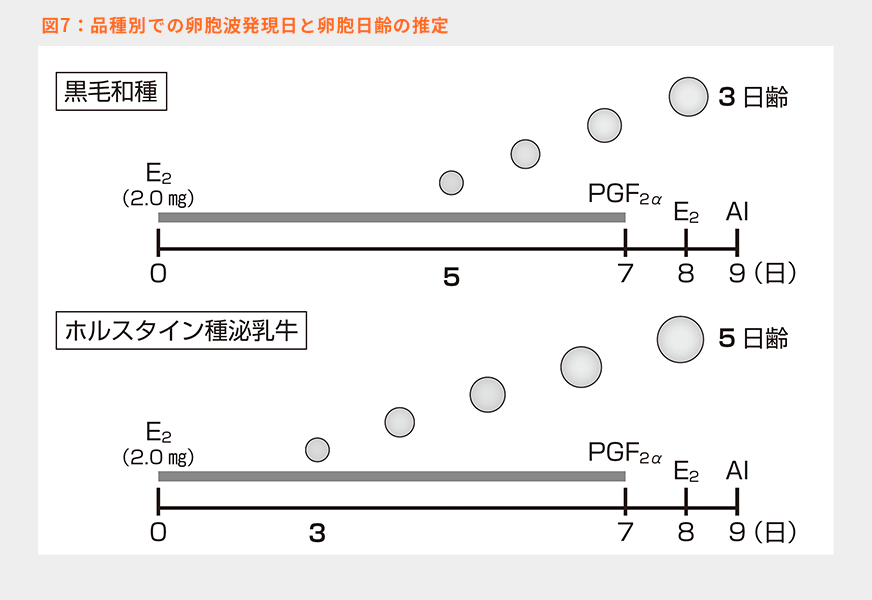
7日間のP4製剤留置でE2+P4プログラムを黒毛和種に対して実施した時に、「定時授精した3~4日後に発情がまた発現した」という現象に出会った先生方もおられるのではないだろうか? また、「定時授精を予定していた日に卵胞が小さくて授精ができない」などのケースはないだろうか?
これらの原因として、卵胞発育期間の不足が考えられる。図7のように黒毛和種では初回のE2投与から5日目に卵胞波発現が起きた場合、2回目のE2投与日に卵胞は3日齢となる。しかし表1でも示したように、この日齢だとLHサージに対して反応できず排卵できない可能性があり、卵胞はそのまま発育が継続し、その後2~3日経て十分に成熟したところで再度発情が発現するのではないかと推測される。この点に関しては今後調査の必要があると考えられるが、筆者が黒毛和種の卵巣動態を観察するなかで、ホルスタイン種泌乳牛に比較して卵胞波発現時期が1~2日遅れることを確認している。
そのため、筆者はこのプログラムをホルスタイン種泌乳牛または黒毛和種に実施する場合、ホルスタイン種に対しては8~9日間、黒毛和種に対しては9~10日間のP4製剤留置期間にし、その後の処置は同じにしている。ホルスタイン種に関しても9日間留置した方が授精時の卵胞も大きくなり、発情発現も強くなるので、筆者は通常は9日間の留置で行っている。
ただし、牛の分娩後日数・乳量を考慮しながら、分娩後日数が早い牛、乳量が多い牛に関しては7~8日間留置にしている。
それぞれの適応
オブシンクとE2+P4プログラムの原理について説明してきたが、それぞれの適応について説明する。
オブシンクは排卵可能な主席卵胞が存在すれば、GnRH投与後1.5日で品種、年齢、体重を問わず排卵させることができるので、新規卵胞波発現をほぼ同時期に揃えることができるという点では非常に優れている。しかしながら、黄体が存在していてもその時期が発情周期の12日以降であればP4製剤の併用をしないとPGF2α投与前に発情発現してしまう可能性があるので、発情周期を意識する必要がある。また、オブシンクの開始時期に黄体が不在の場合は受胎率が低下することが示されている14)、この場合はP4製剤を併用することで受胎率が向上することが示されている。卵巣静止・卵胞嚢腫に対して行う時はP4の併用が重要になってくる。
E2+P4プログラムは発情周期に関係なく使用できる。使いやすい反面、卵胞波発現時期にバラツキが出るので9日間前後は留置した方が無難と考えている。卵巣静止の牛に対しても十分に効果があるが、経験的には卵胞嚢腫に対してはうまく新規卵胞波を誘起できていないと感じているため、卵胞嚢腫にはオブシンクとP4製剤の併用で処置を行っている。E2+P4プログラムの適応に関しては、どのような牛に対してより効果的なのかは今後の研究のなかで明らかにしていく必要があると考えている。
まとめ
本稿では、定時人工授精プログラムの原理、注意点について議論してきた。細かい話が多く、丁寧に分かりやすく伝えられているか気になるところであるが、それぞれのプログラムの原理を押さえることで、P4製剤留置期間やホルモン剤の投与タイミングなども組み合わせることができると考えている。例えば、オブシンクの2回目のGnRHの代わりにE2を使用してもよいが、その場合はPGF2α投与の24時間後に投与し、授精はさらにその翌日とすればよい。E2+P4プログラム最後のE2をGnRHに替える場合、PGF2α投与から48~56時間後に投与し、その8~24時間後に授精すればよいことになる。獣医師そして畜産農家の互いの都合のなかでホルモン剤投与のタイミングを変化させるのも1つの考え方であろう。
定時人工授精プログラムは獣医師や畜産農家の労力の軽減を目的に行うことが重要であると考えており、プログラムの作業に振り回されないように、効率的な活用ができたらと思う。また、ご不明な点やご質問などあればご連絡をいただきたい。臨床の現場で活躍されている先生方の実施方法や工夫されていることをお聞きしていくなかで、より効果的な繁殖管理方法につなげることができたらと思う。