はじめに
ゾエティス・ジャパンから新しい牛向けワクチン「ティーエスブイ®3(以下、TSV®-3)」の発売が開始された(図1)。TSV®-3はTSV®-2に牛RSウイルス(BRSV)抗原を新たに追加した鼻腔粘膜ワクチンであり、局所免疫と全身性免疫応答による呼吸器のさらなる防御効果が期待でき、牛ワクチンプログラムを充実させる新たな選択肢となる。実際にTSV®-3は米国の牛ワクチンプログラムの重要な構成要素の1つとなっており、非特異的免疫刺激とともに3つの重要な呼吸器病(Bovine Respiratory Disease:BRD)の原因ウイルスのコントロールを実現している。
本稿では、自然免疫と獲得免疫を中心に呼吸器における生体防御メカニズムを解説するとともに、TSV®-3の特長を紹介する。
呼吸器免疫系の重要な構成要素
抗原に直接曝露される他の内臓器官と同様に、牛の呼吸器においても、BRDから自らを防御するための2つの主要な免疫系(粘膜〈局所〉免疫系と全身免疫系)が存在し、これらが病原体の体内移動と感染レベルのコントロールにおいて重要な役割を果たしている。このうち、病原体曝露の初期段階における感染コントロールでは粘膜免疫が重要である。
気道の自然免疫
気道防御において最も重要なメカニズムは局所における自然免疫である。上部気道と下部気道の自然免疫システムは、しばしば1つのシステムとして取り上げられるものの、機能性や関与する細胞の種類において大きく異なっている。これは主として、下部気道は無菌である一方、上部気道には正常でも細菌(Pasteurella multocida,Mannheimia haemolytica,Histophilus somniなど)が多数生息しているという事実による1~3)。
上部気道
鼻腔内や上部気道の粘膜表面は、環境要因によるストレスや損傷を軽減するとともに下部気道への感染性病原体の移動を制御するために、大きな役割を果たしている。また鼻甲介は、気道内の適度な温度・湿度調整を担っており、繊細な気道を保護している。
上部気道の主要防御メカニズムは非炎症性であり、その主な目的は病原体の接着と肺への移動の阻止にある。上部気道免疫系の2つの主要な細胞は杯細胞と線毛を有する上皮細胞である。この2つの細胞が粘液線毛輸送系(「エスカレーター」)を形成する。分泌された粘液が異物を捕らえ、次に線毛がそれを気道から掃き出すことにより、異物は嚥下されるか発咳や鼻汁とともに排出される。鼻腔内の構造上の蛇行(鼻毛、線毛、および粘液の存在)により、流入してくる空気から、きわめて小さなもの(5ミクロン未満)を除くすべての粒子をろ過する1)。インターフェロンなどを含むサイトカインやリンフォカインも、上部気道と下部気道の保護に関与している。
下部気道
健康な動物の下部気道は無菌である。上部気道とは異なり、ここでの免疫応答は主に炎症性であり、感染性病原体を殺滅・排除することを目的とする。
分泌性の防御としては、侵入物を溶解する補体、肺胞の崩壊を防いでマクロファージの機能を促進する肺胞内面の界面活性物質(サーファクタント)、細菌の接着を阻止するフィブロネクチン、および異物粒子の定着を妨げて排出を促進する粘液が含まれる。分泌性の防御としては、侵入物を溶解する補体、肺胞の崩壊を防いでマクロファージの機能を促進する肺胞内面の界面活性物質(サーファクタント)、細菌の接着を阻止するフィブロネクチン、および異物粒子の定着を妨げて排出を促進する粘液が含まれる。
マクロファージと樹状細胞は最も重要な食細胞であり、侵入異物を殺滅し、その情報(または少なくともその重要な抗原)をリンパ球に提示して免疫応答を刺激する。非炎症状態では、肺胞腔にマクロファージが80%、T細胞と樹状細胞が20%の割合で含まれている2)。樹状細胞が抗原提示に関与する一方、肺胞マクロファージは感染の排除にきわめて重要な役割を担っている。詳細は、獲得免疫の項で取り上げる。
好中球は下部気道における第二の防御ラインとして働くが、侵入異物との戦いで死滅することも多いため、有害となる好中球内の酵素とともに除去される必要がある。好中球の動員とその後の好中球の死滅は、細菌性肺炎の発症と重篤度に影響を及ぼすことがある3~5)。
気道感染における自然免疫の重要性は見過ごせない点である。多くの病原体が気道を攻撃し、その後に肺へ侵入するが、自然免疫系が正常に機能している限りは、病原体の曝露による疾病発現をコントロールできることが研究で示されている6,7)。
気道の獲得免疫
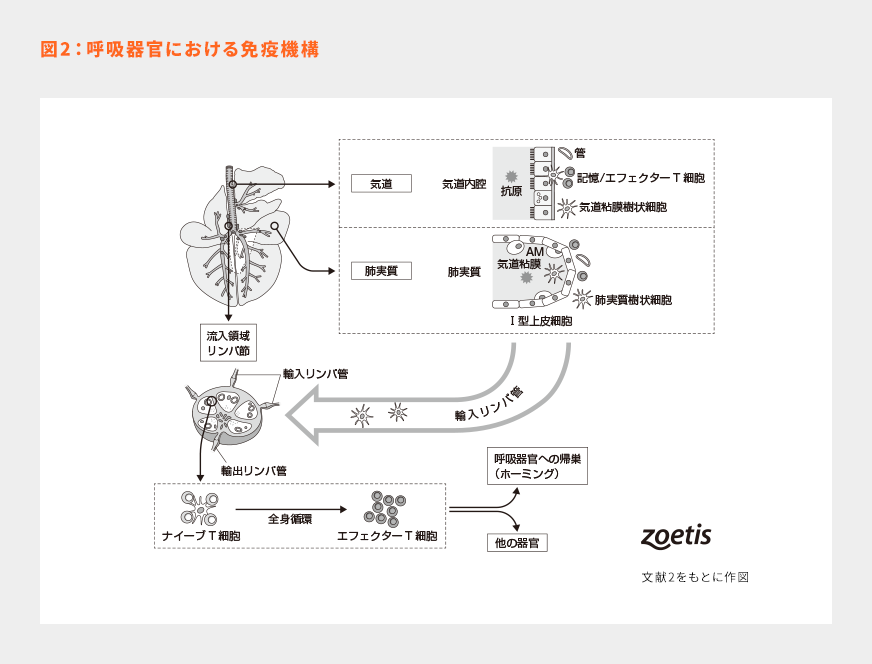
牛の上部気道から侵入した病原体は活発に貪食される。マクロファージのほかに、密接に統合された気道粘膜樹状細胞(AMDCs)のネットワークが存在する。また、肺胞腔にも肺実質樹状細胞(LPDCs)と呼ばれるネットワークが存在する。通常の状態では、気道の樹状細胞は侵入する病原体を取り込む能力が高いものの、抗原提示能力は比較的低い。これは、病原体の監視をしながら、免疫系刺激を制限するうえで重要となる。また、これは上部気道内での正常な共生菌との繊細なバランスを保つうえでの一助ともなる。
気道の樹状細胞は、上皮層を通じて樹状突起を伸長させ、侵入してくる病原体を取り込む8,9)。そこで処理された抗原は、粘膜にある気管支関連リンパ組織(BALT)内のリンパ球(BおよびT細胞)に提示される10)。これらの細胞が以前に感作されていた場合、この抗原提示に応答してサイトカインと抗体が迅速に産生・放出される。上部気道では免疫グロブリン(Ig)Aが主要な分泌型抗体であり、一方、IgG1は主に下部気道における防御を担っている11)。
抗原が有する病原体関連分子パターン(PAMPs)に曝露されると、Toll様受容体などのパターン認識受容体(PRRs)がそれを認識し、シグナルを発して肺の樹状細胞を成熟させる。肺の樹状細胞は貪食活動を停止し、主要組織適合遺伝子複合体(MHC)とともにエピトープを表面に移動させることにより抗原提示とサイトカインの放出を劇的に増加させる12)。これらの細胞は局所リンパ節に移動し、そこで未熟なCD4およびCD8陽性T細胞(ナイーブT細胞)を刺激してリンフォカイン分泌細胞(エフェクターT細胞)へと分化させる。分化した細胞は全身循環に入り、また気道局所のリンパ節に戻ってくる(ホーミング)。これらの細胞は次に抗原特異的免疫応答とほかの免疫細胞の動員を開始して、侵入している病原体に対峙する(図2)。
TSV®-3の特長
TSV®-2は,牛ヘルペスウイルス(BHV-1)と牛パラインフルエンザウイルス(PI-3)の温度感受性ウイルス株を応用したユニークな技術を取り入れている。これらのウイルス株は自然界には存在せず、牛の正常な体内温度よりも低い温度帯(35~36℃)でウイルス複製が最大となる増殖パターンを示す。逆に、この温度帯を上回って39℃以上になると、ウイルスの複製が抑制される。そのため、体内温度より低めの温度帯である鼻腔内(上部気道)では高レベルでウイルスが複製されるが、体内深部では増殖は抑制される。したがって、TSV®-2は強力かつ迅速な免疫応答を惹起することができ、妊娠牛においても安全性が確認されている。
一方、TSV®-3はTSV®-2にBRSV抗原を新たに追加した形の鼻腔粘膜ワクチンである。TSV®-3は世界でも重要な牛呼吸器病の病原体の1つであるBRSV対策において、注射型ワクチンとは異なる新しい選択肢を提供する。BRSVの弱毒化株を筋肉内に投与した場合、体内でウイルスの複製が認められるのは数回のみと制限される13~15)。注射型ワクチンでは、この制限されたウイルス複製により血清中の中和抗体産生や全身の細胞性免疫を刺激することとなる。これに対して、鼻腔粘膜ワクチンでは、通常の感染部位である上部気道でウイルスの複製が起こるため、中和抗体産生と局所の細胞性免疫をより刺激することができる。そのため、TSV®-3では感染レベルを低減し、症状を軽減することができる16~18)。
TSV®-3(および程度は低いものの、弱毒化したBRSVワクチン株)の鼻腔内投与には、もう1つのユニークな特徴がある。鼻腔粘膜ワクチンは注射型ワクチンと比較して、投与後、またはそれに続く野外株曝露後、特に鼻汁中においてサイトカインの非常に迅速で高いレベルでの放出が認められる。このことは、インターフェロンの評価時に複数の試験で実証されている19~23)。インターフェロンは、動物体内においてウイルス感染の排除に関わるサイトカインの1つであるが、主として気道と肺の局所免疫系を刺激し、ウイルスに対抗する。また、その作用はTSV®-3投与後の鼻腔内でおよそ7~14日間持続することが子牛と成牛において実証されている24,25)。
TSV®-3投与後の免疫持続期間
生後1週齢の子牛にTSV®-3のBHV-1およびBRSVに対する免疫持続期間を検討したところ、BHV-1に対する免疫持続期間は193日であった26)。一方、BRSVに対する免疫持続期間は、子牛の免疫系が成熟するにつれて延長する。このことは、生後1週齢の子牛にTSV®-3を投与した場合のBRSVに対する免疫持続期間は少なくとも64日であった17,27)が、より成長した子牛では免疫持続期間は3~5カ月まで延長した28,29)ことからも裏付けられている。また、TSV®-3による免疫応答が移行抗体により干渉されないことも実証されている。
まとめ
BRSV抗原が追加されたTSV®-3は、TSV®-2と同様に迅速かつ強力な局所免疫の誘導が期待できると同時に、牛RSウイルス感染症に対して高い防御効果を示す。さらに、移行抗体の影響を受けず、出生直後より投与することが可能で、これまでの注射型ワクチンではカバーできなかった新生子牛からのワクチンプログラムを構築するための新しいツールとなるだろう。
参考文献
- 1) Perino L.J.:Veterinary Learning Systems,18~37(1996)
- 2) Von Garnier C.,Nicod L.P.:Swiss Med Wkly,139(13-14),186~192(2009)
- 3) Gonzalez C.T.,Maheswaran S.K.:Br Vet J,149(2),183~193(1993)
- 4) Ryu H.,Kaeberle M.L., Roth J.A.,et al.:Infect Immun,43(1),66~71(1984)
- 5) Whiteley L.O.,Maheswaran S.K.,Weiss D.J.,et al.:J Vet Intern Med,6(1),11~22(1992)
- 6) Jakab J.G.:In Bovine Respiratory Disease A symposium(Loan R.W.ed.),223,Texas A&M University Press,Texas(1984)
- 7) Babiuk L.A.,Acres S.D.:In Bovine Respiratory Disease A symposium(Loan R.W.ed.),287,Texas A&M University Press,Texas(1984)
- 8) Holt P.G.,Strickland D.H.,Thomas J.A.,et al.:Nat Rev Immunol,8(2),142~152(2008)
- 9) Johnsen F.L.,Strickland D.H.,Thomas J.A.,et al.:J Immunol,177(9),5861~5867(2006)
- 10) Rangel-Moreno J., Hartson L., Navarro C., et al.:J Clin Invest,116(12), 3183~3194(2006)
- 11) Butler J.E.:Vet Immunol Immunopathol,4,43(1982)
- 12) Gallucci S.,Matzinger P.:Curr Opin Immunol,13(1),114~119(2001)
- 13) Kimman T.G.,Westenbrink F.,Straver P.J.:Vet Immunol Immunopathol,22(2),145~160(1989)
- 14) Kimman T.G.,Westenbrink F.:Arch Virol,112(1~2),1~25(1990)
- 15) Kimman T.G.,Westenbrink F.,Schreuder B.E.,et al.:J Clin Microbiol,25(6),1097~1106(1987)
- 16) Ellis J.,Gow S.,West K.,et al.:J Am Vet Med Assoc,230(2),233~243(2007)
- 17) Ellis J.,Gow S.,Goji N.:J Am Vet Med Assoc,236(9),991~999(2010)
- 18) Inforce3 Package Insert in US
- 19) Gerber J.D.,Marron A.E.,Kucera C.J.:Am J Vet Res,39(5),745~760(1978)
- 20) Todd J.D.:J Am Vet Med Assoc,163(7),807~809(1983)
- 21) Zygraich N.,Huygelen C.,Vascoboinic E.:Proc Intern Cong IABS,26,8~14(1974)
- 22) Zygraich N.,Lobmann M.,Vascoboinic E.,et al.:Res Vet Sci,16,328~335(1974)
- 23) Zygraich N.,Huygelen C.,Vascoboinic E.:Proc Intern Cong IABS,33,379~383(1976)
- 24) Gray D.,Ellis J.A., Gow S.P.,et al.:J Proteomics,204,103397(2019)
- 25) Cortese V.S.,Woolums A.,Hurley D.J.,et al.:Vet Immunol Immunopathol,187,35~41(2017)
- 26) Mahan S.M.,Sobecki B.,Johnson J.,et al.:J Am Vet Med Assoc,248(11),1280~1286(2016)
- 27) Ellis J.A.,Gow S.P.,Mahan S.,et al.:J Am Vet Med Assoc,243(11),1602~1608(2013)
- 28) Stoltenow C.,Cortese V.S.,Seeger J.T.,et al.:Bov Pract,45(2),132~138(2011)
- 29) Cortese V.S.,Seeger J.T.,Trejo C.,et al.:JSM Allergy Asthma,3(1),1021~1026(2018)